Einen Schlüsselmechanismus bei der Entstehung neurodegenerativer Erkrankungen wie Parkinson und Alzheimer haben WissenschafterInnen der Karl-Franzens-Universität Graz identifiziert. Sie konnten erstmals im Detail beobachten, wie eine Wechselwirkung mit einem Protein namens SERF zum krankhaften Zusammenklumpen bestimmter Proteine führt, die dadurch ihre Aufgaben in der Zelle nicht mehr korrekt erfüllen können. Damit ist die Forschung der Entwicklung von Therapien einen Schritt näher gekommen. Die bahnbrechenden Erkenntnisse wurden am 26. Juli 2012 erstmals im renommierten Fachjournal „Cell Reports“ online veröffentlicht.
Bei sogenannten amyloiden Krankheiten wie Parkinson, Alzheimer, Creutzfeldt-Jakob und Chorea Huntington verlieren bestimmte Proteine ihre ursprüngliche dreidimensionale Struktur, in der Wissenschaft „protein misfolding“ genannt. Sie aggregieren zu fadenförmigen Fasern, sogenannten „Amyloiden“. Somit können sie ihre Funktionen für einen ordnungsgemäßen Ablauf der biochemischen Prozesse in den Zellen nicht mehr erfüllen. Solche amyloide Ablagerungen lassen sich in sterbenden Neuronen im Gehirn beobachten.
Wie es dazu kommt, das konnte Dr. Fabio Falsone vom Institut für Pharmazeutische Wissenschaften der Karl-Franzens-Universität Graz im Rahmen eines vom Österreichischen Wissenschaftsfonds FWF geförderten Forschungsprojekts nun nachweisen. Gemeinsam mit seinem Team hat er die Schlüsselproteine für die Entstehung der oben genannten Krankheiten im Labor isoliert. „So konnten wir – unabhängig von anderen zellulären Prozessen – beobachten, was geschieht, wenn diese Proteine bestimmten Einflüssen ausgesetzt sind“, erklärt Fabio Falsone.
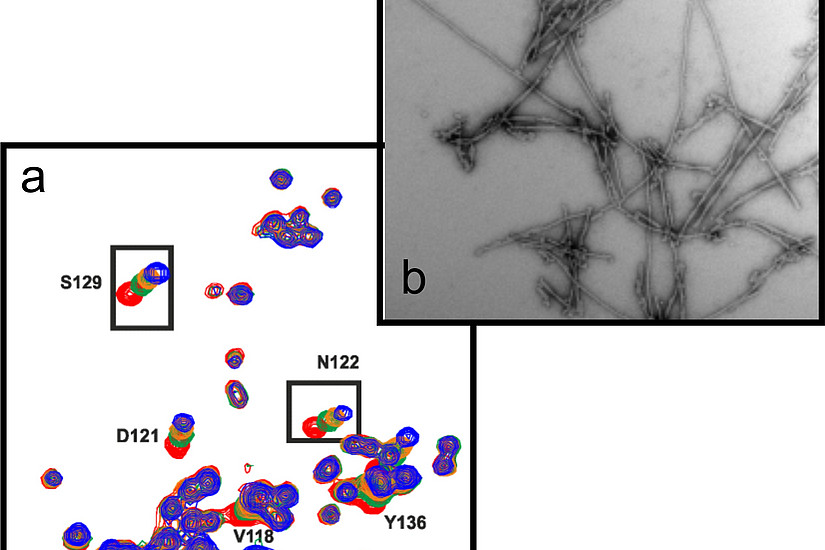
Das spektakuläre Ergebnis dieser Untersuchungen war: „Die Amyloidbildung – die faserförmige Aggregation – all dieser Proteine wird beschleunigt, wenn sie mit einem weiteren Protein namens SERF wechselwirken“, berichtet Falsone. „SERF, das in den meisten Zellen vorkommt, bindet an die Proteine und verändert ihre Struktur, sodass sie Amyloide bilden, unabhängig von anderen Faktoren. Unspezifische Aggregationsprozesse werden hingegen nicht beeinflusst. Das lässt vermuten, dass SERF ein einzigartiger amyloidfördernder Faktor ist.“ Diese Einblicke ermöglichte den WissenschafterInnen die Methode der Kernspinresonanzspektroskopie (NMR), mit der sich Proteine und deren Wechselwirkungen auf atomarer Ebene betrachten lassen.
Als Nächstes möchten die ForscherInnen nun herausfinden, aus welchem Grund ein körpereigenes Molekül wie SERF einen schädlichen Prozess wie die amyloide Aggregation in Gang setzt. Falsone kooperiert bei seiner Arbeit eng mit KollegInnen des Instituts für Chemie der Karl-Franzens-Universität Graz, mit WissenschafterInnen der Medizinischen Universität Graz sowie mit Arbeitsgruppen in Australien und den Niederlanden.
Publikation:
Falsone et al.: „SERF protein is a direct modifier of amyloid fiber assembly”, Cell Reports (2012), 2, 1-14; doi: 10.1016/j.celrep.2012.06.012